KHTN 9 Bài 18: Tính chất chung của kim loại Giải KHTN 9 Kết nối tri thức trang 87, 88, 89, 90, 91
Giải bài tập Khoa học tự nhiên 9 Bài 18: Tính chất chung của kim loại hay nhất, ngắn gọn giúp các em học sinh dễ dàng làm bài tập trong SGK Khoa học tự nhiên 9 Kết nối tri thức với cuộc sống trang 87, 88, 89, 90, 91.
Qua đó, các em hiểu rõ các tính chất vật lí, hóa học của kim loại. Đồng thời, cũng giúp thầy cô tham khảo soạn giáo án Bài 18 Chương VI: Kim loại, sự khác nhau cơ bản giữa phi kim và kim loại cho học sinh của mình. Mời thầy cô và các em cùng theo dõi bài viết dưới đây của Eballsviet.com:
Giải KHTN Lớp 9 Bài 18: Tính chất chung của kim loại
I. Tính chất vật lí của kim loại
Hoạt động: Trả lời các câu hỏi sau:
1. Khi uốn các thanh thuỷ tinh, gỗ, nhôm (aluminium), thép (thành phần chính là sắt), thanh nào có thể bị uốn cong mà không gãy?
2. Khi dùng búa đập vào các vật thể bằng đồng, gỗ, vàng, nhôm, cao su, sứ, vật thể nào bị biến dạng (vỡ vụn, dát mỏng,...)
3. Khi nhúng thìa nhôm vào cốc nước sôi, tay cầm cán thìa sẽ thấy nóng. Hiện tượng này chứng tỏ tính chất gì của nhôm?
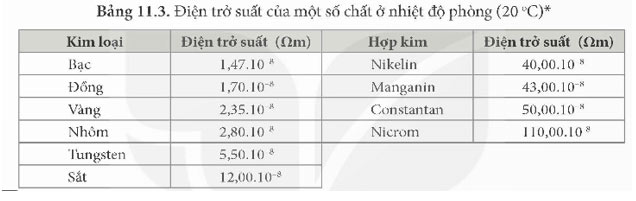
4. Dựa vào các số liệu trong Bảng 11.3 (trang 57), hãy giải thích vì sao dây dẫn điện thường làm bằng đồng và nhôm mà không làm bằng sắt.
5. Quan sát bề mặt viên gạch, mảnh nhôm, mảnh đồng, bề mặt nào có vẻ sáng lấp lánh (ánh kim)?
Trả lời:
1. Các thanh nhôm (aluminium), thép (thành phần chính là sắt) có thể uốn cong mà không bị gãy.
2. Các vật thể bằng đồng, vàng, nhôm, sứ có thể bị biến dạng, trong đó:
+ Vật liệu bằng đồng, vàng, nhôm bị dát mỏng.
+ Vật liệu bằng sứ bị vỡ vụn.
3. Khi nhúng thìa nhôm vào cốc nước sôi, tay cầm cán thìa sẽ thấy nóng. Hiện tượng này chứng tỏ tính dẫn nhiệt của nhôm.
4. Điện trở suất của đồng và nhôm nhỏ hơn nhiều so với sắt do đó dây dẫn điện thường làm bằng đồng và nhôm mà không làm bằng sắt.
5. Bề mặt mảnh nhôm, mảnh đồng có vẻ sáng lấp lánh (ánh kim).
Câu hỏi: Quan sát Hình 18.1 và cho biết những ứng dụng của các kim loại vàng, đồng, nhôm, sắt dựa trên những tính chất vật lí nào?

Trả lời:
a) Vàng được dùng làm đồ trang sức do dễ dát mỏng, dễ kéo sợi, có ánh kim đẹp.
b) Đồng được dùng làm lõi dây dẫn điện do dẫn điện tốt.
c) Nhôm được dùng làm xoong, nồi, chảo do dẫn nhiệt tốt.
d) Thép được sử dụng trong xây dựng, cầu đường do cứng và bền.
II. Tính chất hóa học của kim loại
1. Tác dụng với phi kim
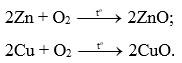
Câu hỏi 1: Viết phương trình hóa học của phản ứng giữa kẽm (zinc), đồng với khí oxygen.
Trả lời:
Phương trình hoá học:
Câu hỏi 2: Tại sao đồ vật bằng kim loại như sắt, nhôm, kẽm, đồng,… để lâu trong không khí bị mất ánh kim, còn đồ trang sức bằng vàng để lâu trong không khí vẫn sáng đẹp?
Trả lời:
Do sắt, nhôm, kẽm, đồng … có thể phản ứng với oxygen có trong không khí tạo thành lớp oxide làm mất đi vẻ sáng (ánh kim) của kim loại.
Còn vàng không phản ứng với oxygen (hay hơi nước, CO2 …) có trong không khí nên đồ trang sức bằng vàng để lâu trong không khí vẫn sáng đẹp.
Hoạt động: Nghiên cứu phản ứng của một số kim loại với chlorine
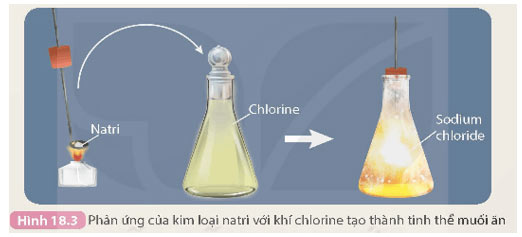
- Thí nghiệm natri (sodium) tác dụng với chlorine được thực hiện như sau:
Đun nóng chảy một mẩu natri rồi cho nhanh vào bình khí chlorine (màu vàng lục), natri cháy trong khí chlorine tạo thành tinh thể muối ăn có màu trắng (Hình 18.3).
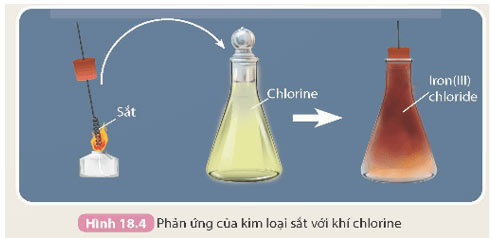
- Thí nghiệm sắt tác dụng với khí chlorine được thực hiện như sau:
Đốt đầu của dây sắt (đã được uốn thành hình lò xo) bằng đèn cồn đến nóng đỏ rồi đưa nhanh vào bình khí chlorine, sắt cháy trong khí chlorine tạo thành muối iron(III) chloride có màu nâu đỏ (Hình 18.4).
Thực hiện yêu cầu sau:
Viết phương trình hóa học của phản ứng xảy ra ở trên.
Trả lời:
- Natri (sodium) tác dụng với chlorine:
2Na + Cl2 → 2NaCl
- Sắt tác dụng với khí chlorine:
2Fe + 3Cl2 →2FeCl3
Câu hỏi: Viết phương trình hoá học của các phản ứng giữa kim loại Mg, Zn với phi kim S.
Trả lời:
Các phương trình hóa học:
Mg + S → MgS;
Zn + S → ZnS.
2. Tác dụng với nước
Câu hỏi: Biết rằng ở nhiệt độ cao, hơi nước tác dụng với sắt tạo thành Fe3O4. Viết phương trình hoá học của phản ứng.
Trả lời:
Phương trình hoá học:
4H2O + 3Fe → Fe3O4 + 4H2
3. Tác dụng với dung dịch acid
Câu hỏi 1: Phản ứng của kim loại kẽm với dung dịch hydrochloric acid được dùng để điều chế khí hydrogen trong phòng thí nghiệm. Tính lượng kẽm và thể tích dung dịch hydrochloric acid 1M cần dùng để điều chế 250 mL khí hydrogen (điều kiện chuẩn).
Trả lời:
Ta có:
![]() \(n_{H2}=\frac{0,25}{24,79}=0,1(mol)\)
\(n_{H2}=\frac{0,25}{24,79}=0,1(mol)\)
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2
Theo PTHH:
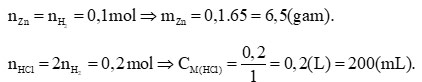
Câu hỏi 2: Viết phương trình hóa học của phản ứng xảy ra khi cho kim loại magnesium vào dung dịch hydrochloric acid.
Trả lời:
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:












 Đề thi giữa kì 2 lớp 9
Đề thi giữa kì 2 lớp 9
 Đề thi học kì 2 Lớp 9
Đề thi học kì 2 Lớp 9
 Đề thi giữa kì 1 lớp 9
Đề thi giữa kì 1 lớp 9
 Đề thi học kì 1 Lớp 9
Đề thi học kì 1 Lớp 9
 Toán 9
Toán 9
 Toán 9 Kết nối tri thức
Toán 9 Kết nối tri thức
 Toán 9 Cánh Diều
Toán 9 Cánh Diều
 Toán 9 Chân trời sáng tạo
Toán 9 Chân trời sáng tạo
 Văn 9 Kết nối tri thức
Văn 9 Kết nối tri thức