KHTN 9 Bài 19: Dãy hoạt động hóa học Giải KHTN 9 Kết nối tri thức trang 92, 93, 94
Giải KHTN 9 Bài 19: Dãy hoạt động hóa học giúp các em học sinh lớp 9 tham khảo để nhanh chóng trả lời các câu hỏi trong sách Khoa học tự nhiên 9 Kết nối tri thức với cuộc sống trang 92, 93, 94.
Qua đó, cũng giúp thầy cô tham khảo để soạn giáo án Bài 19 Chương VI: Kim loại, sự khác nhau cơ bản giữa phi kim và kim loại SGK Khoa học tự nhiên 9 Kết nối tri thức với cuộc sống cho học sinh của mình theo chương trình mới. Vậy mời thầy cô và các em cùng theo dõi nội dung chi tiết trong bài viết dưới đây của Eballsviet.com:
Giải KHTN Lớp 9 Bài 19: Dãy hoạt động hóa học
I. Xây dựng dãy hoạt động hóa học
Hoạt động: Sắp xếp mức độ hoạt động hóa học của: Na, Fe, H, Cu, Ag
1. Khảo sát phản ứng của các kim loại Na, Fe, Cu với nước
Chuẩn bị: 1 mẩu kim loại natri bằng hạt đậu xanh, đinh sắt và dây đồng; 2 ống nghiệm đựng nước được đánh số (1), (2), chậu thuỷ tinh dựng nước.
Tiến hành: Cho mẩu natri vào chậu thuỷ tinh đựng nước, đinh sắt vào ống nghiệm (1), dây đồng vào ống nghiệm (2).
(Phản ứng của kim loại natri với nước xem Hình 18.5, Bài 18).
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
Dựa vào khả năng phản ứng với nước, có thể chia các kim loại natri, đồng và sắt thành mấy nhóm? So sánh mức độ hoạt động hoá học của các nhóm kim loại này.
2. Khảo sát phản ứng của kim loại Fe, Cu với dung dịch acid
Chuẩn bị: đinh sắt, dây đồng, hai ống nghiệm đựng cùng một lượng dung dịch HCl cùng nồng độ.
Tiến hành: Cho đinh sắt, dây đồng vào từng ống nghiệm riêng biệt đựng dung dịch HCl.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
a) Hãy cho biết kim loại nào phản ứng được với dung dịch HCl (đẩy được hydrogen ra khỏi acid).
b) So sánh mức độ hoạt động hóa học của sắt, đồng với hydrogen.
c) So sánh mức độ hoạt động hóa học của sắt với đồng.

3. So sánh mức độ hoạt động hóa học của kim loại Ag và Cu
Chuẩn bị: dây đồng, dung dịch AgNO3 2%; ống nghiệm, panh.
Tiến hành: Dùng panh kẹp dây đồng đã được uốn thành hình lò xo đưa vào ống nghiệm chứa dung dịch AgNO3 2%.
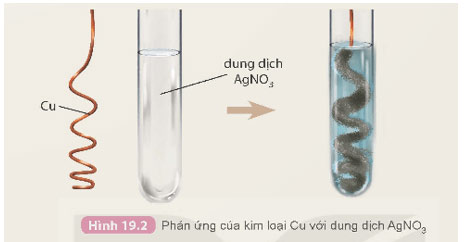
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
a) Mô tả hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
b) So sánh mức độ hoạt động của kim loại đồng và bạc. Giải thích.
c) Qua ba thí nghiệm ở trên, hãy sắp xếp mức độ hoạt động hóa học của các kim loại Na, Fe, Cu, Ag và H thành dãy theo chiều giảm dần.
Trả lời:
1. Khảo sát phản ứng của các kim loại Na, Fe, Cu với nước
Dựa vào khả năng phản ứng với nước, có thể chia các kim loại natri, đồng và sắt thành hai nhóm:
+ Nhóm 1: Phản ứng được với nước ở điều kiện thường: natri.
+ Nhóm 2: Không phản ứng được với nước ở điều kiện thường: đồng và sắt.
So sánh: Mức độ hoạt động hoá học của nhóm 1 mạnh hơn nhóm 2.
2. Khảo sát phản ứng của kim loại Fe, Cu với dung dịch acid
a) Kim loại Fe phản ứng được với dung dịch HCl (đẩy được hydrogen ra khỏi acid).
b) Mức độ hoạt động của sắt mạnh hơn hydrogen; mức độ hoạt động của đồng yếu hơn hydrogen.
c) Mức độ hoạt động hoá học của sắt mạnh hơn đồng.
3. So sánh mức độ hoạt động hoá học của kim loại Ag và Cu
a) Hiện tượng:
- Có lớp kim loại trắng bạc bám ngoài dây đồng.
- Dung dịch chuyển dần từ không màu sang màu xanh.
Phương trình hóa học:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
b) Mức độ hóa học của đồng mạnh hơn bạc. Do đồng đẩy được bạc ra khỏi muối.
c) Mức độ hoạt động hóa học của các kim loại và H giảm dần theo thứ tự:
Na, Fe, H, Cu, Ag.
II. Ý nghĩa dãy hoạt động hóa học
Dự đoán hiện tượng xảy ra và viết phương trình hóa học của phản ứng (nếu có) trong các thí nghiệm sau:
1. Rót dung dịch H2SO4 loãng vào 3 ống nghiệm, mỗi ống khoảng 3 mL. Lần lượt cho vào mỗi ống nghiệm một mẩu kim loại trong số ba kim loại sau: Mg, Ag, Zn.
2. Cho viên kẽm vào ống nghiệm chứa dung dịch AgNO3.
3. Rót vào ba cốc thuỷ tinh loại 100 mL, mỗi cốc 25 mL nước cất. Cho vào mỗi cốc một mẩu kim loại trong số ba kim loại sau: Cu, Fe, Ca.
Trả lời:
Dự đoán:
1. Thí nghiệm 1:
Hiện tượng:
- Ống nghiệm chứa Mg và ống nghiệm chứa Zn có sủi bọt khí, kim loại trong ống nghiệm tan dần.
- Ống nghiệm chứa Ag không có hiện tượng gì.
Phương trình hoá học:
Mg + H2SO4 loãng → MgSO4 + H2
Zn + H2SO4 loãng → ZnSO4 + H2
Ag + H2SO4 loãng → không phản ứng
2. Thí nghiệm 2:
- Hiện tượng: Viên kẽm tan dần, có lớp kim loại trắng sáng bám ngoài viên kẽm.
- Phương trình hoá học:
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
3. Thí nghiệm 3:
- Hiện tượng:
+ Chỉ có cốc cho Ca có phản ứng hoá học xảy ra. Ca tan dần, có khí thoát ra.
+ Hai cốc còn lại không có hiện tượng gì xuất hiện.
- Phương trình hoá học:
Ca + 2H2O → Ca(OH)2 + H2
Chọn file cần tải:
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:












 Đề thi giữa kì 2 lớp 9
Đề thi giữa kì 2 lớp 9
 Đề thi học kì 2 Lớp 9
Đề thi học kì 2 Lớp 9
 Đề thi giữa kì 1 lớp 9
Đề thi giữa kì 1 lớp 9
 Đề thi học kì 1 Lớp 9
Đề thi học kì 1 Lớp 9
 Toán 9
Toán 9
 Toán 9 Kết nối tri thức
Toán 9 Kết nối tri thức
 Toán 9 Cánh Diều
Toán 9 Cánh Diều
 Toán 9 Chân trời sáng tạo
Toán 9 Chân trời sáng tạo
 Văn 9 Kết nối tri thức
Văn 9 Kết nối tri thức









