Bộ đề thi giữa học kì 1 môn Hóa học lớp 10 năm 2024 - 2025 (Sách mới) 16 Đề kiểm tra giữa kì 1 Hóa 10 (Cấu trúc mới - Có đáp án)
Đề thi giữa kì 1 Hóa học 10 năm 2024 - 2025 tổng hợp 16 đề khác nhau có đáp án giải chi tiết kèm theo. Qua tài liệu này giúp các bạn học sinh ôn luyện củng cố kiến thức để biết cách ôn tập đạt kết quả cao.
TOP 16 Đề thi giữa kì 1 Hóa học 10 gồm 3 sách Chân trời sáng tạo, Kết nối tri thức và Cánh diều. Hi vọng qua đề kiểm tra giữa kì 1 Hóa học 10 sẽ giúp các em học sinh lớp 10 dễ dàng ôn tập, hệ thống kiến thức, luyện giải đề, rồi so sánh kết quả thuận tiện hơn. Đồng thời đây cũng là tài liệu hữu ích giúp giáo viên ra đề ôn luyện cho các em học sinh của mình. Vậy sau đây là trọn bộ 16 đề thi giữa kì 1 Hóa học 10 năm 2024 - 2025 mời các bạn cùng theo dõi. Ngoài ra các bạn xem thêm: bộ đề thi giữa kì 1 Lịch sử lớp 10, bộ đề thi giữa học kì 1 môn Ngữ văn 10.
Bộ đề thi giữa kì 1 Hóa học 10 năm 2024 - 2025
- 1. Đề thi giữa kì 1 môn Hóa học 10 Kết nối tri thức
- 2. Đề thi giữa kì 1 môn Hóa học 10 Chân trời sáng tạo
- 3. Đề thi giữa kì 1 môn Hóa học 10 Cánh diều
1. Đề thi giữa kì 1 môn Hóa học 10 Kết nối tri thức
Đề thi giữa kì 1 môn Hóa học 10
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO .…. (Đề có 02 trang) |
ĐỀ KIỂM TRA GIỮA HỌC KỲ 1 NĂM HỌC 20… – 20… Môn: HOÁ HỌC – Lớp 10 Thời gian làm bài: 45 phút (không kể thời gian giao đề) |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Sự biến đổi nào sau đây không phải là một hiện tượng hóa học?
A. Hơi nến cháy trong không khí, tạo thành khí cacbonic và hơi nước.
B. Hòa tan muối ăn vào nước, tạo thành dung dịch muối ăn.
C. Sắt cháy trong lưu huỳnh, tạo thành muối sắt(II) sufua.
D. Khí hiđro cháy trong oxi, tạo thành nước.
Câu 2. Trong nguyên tử, hạt mang điện là
A. electron, neutron.
B. electron.
C. proton, neuton.
D. proton, electron.
Câu 3. Đặc điểm của electron là
A. mang điện tích dương và có khối lượng.
B. mang điện tích âm và có khối lượng.
C. không mang điện và có khối lượng.
D. mang điện tích âm và không có khối lượng.
Câu 4. Nhận định đúng nhất là
A. Các nguyên tử thuộc cùng một nguyên tố hóa học thì có tính chất giống nhau.
B. Tập hợp các nguyên tử có cùng số proton đều thuộc cùng một nguyên tố hóa học.
C. Nguyên tố hóa học là những nguyên tử có cùng số neutron khác nhau số proton.
D. Nguyên tố hóa học là những nguyên tố có cùng điện tích hạt nhân.
Câu 5. Orbital có dạng hình cầu là
A. orbital s.
B. orbital p.
C. orbital
D. orbital f.
Câu 6. Nguyên tử Chlorine (Z = 17) có số eletron hóa trị là:
A. 1.
B. 3.
C. 5.
D. 7.
Câu 7. Trong bảng tuần hoàn, các nguyên tố hóa học được sắp xếp theo ba nguyên tắc. Nguyên tắc nào sau đây đúng?
A. Điện tích hạt nhân tăng dần
B. Cùng số lớp electron xếp cùng cột.
C. Cùng số electron hóa trị xếp cùng hàng.
D. Nguyên tử khối tăng dần.
Câu 8. Cation R+ có cấu hình electron 1s22s22p6. Vị trí (chu kì, nhóm) của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 2, nhóm VIIIA.
B. chu kì 2, nhóm VIIA.
C. chu kì 3, nhóm IA.
D. chu kì 3, nhóm IIA.
Câu 9. Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử:
A. tính kim loại giảm dần, độ âm điện tăng dần.
B. tính phi kim tăng dần, bán kính nguyên tử giảm dần.
C. tính kim loại tăng dần, bán kính nguyên tử tăng dần.
D. độ âm điện giảm dần, tính phi kim tăng dần.
Câu 10. Phát biểu nào sau đây không đúng?
A. Nguyên tử được cấu tạo từ các hạt cơ bản là p, n, e.
B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
C. Hạt nhân nguyên tử cấu tạo bởi các hạt proton và hạt neutron.
D. Vỏ nguyên tử được cấu tạo từ các hạt electron
Câu 11. Nguyên tử nguyên tố F có 9 proton, 9 electron và 10 neutron. Số hiệu nguyên tử của F là
A. 9.
B. +9.
C. 10.
D. +10.
.............
Đáp án đề thi giữa kì 1 Hóa học 10
Phần I: Mỗi câu trả lời đúng được 0,25 điểm
| Câu | Đáp án | Câu | Đáp án |
| 1 | B | 10 | B |
| 2 | D | 11 | A |
| 3 | B | 12 | C |
| 4 | B | 13 | A |
| 5 | A | 14 | A |
| 6 | D | 15 | C |
| 7 | A | 16 | B |
| 8 | C | 17 | C |
| 9 | C | 18 | B |
Phần II: Điểm tối đa của 01 câu hỏi là 1 điểm
- Thí sinh chỉ lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm
- Thí sinh chỉ lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm
- Thí sinh chỉ lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm
- Thí sinh lựa chọn chính xác cả 04 ý trong 1 câu hỏi được 1 điểm
|
Câu |
Lệnh hỏi |
Đáp án (Đ/S) |
Câu |
Lệnh hỏi |
Đáp án (Đ/S) |
|
1 |
a |
S |
3 |
a |
Đ |
|
b |
Đ |
b |
Đ |
||
|
c |
S |
c |
S |
||
|
d |
Đ |
d |
S |
||
|
2 |
a |
S |
4 |
a |
Đ |
|
b |
Đ |
b |
S |
||
|
c |
S |
c |
Đ |
||
|
d |
Đ |
d |
Đ |
Phần III: Mỗi câu trả lời đúng được 0,25 điểm
|
Câu |
Đáp án |
Câu |
Đáp án |
|
1 |
143 |
4 |
2 |
|
2 |
5,85 |
5 |
3 |
|
3 |
3 |
6 |
4 |
2. Đề thi giữa kì 1 môn Hóa học 10 Chân trời sáng tạo
Đề thi giữa kì 1 Hóa học 10
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO .…. (Đề có 02 trang) |
ĐỀ KIỂM TRA GIỮA HỌC KỲ 1 NĂM HỌC 20… – 20… Môn: HOÁ HỌC – Lớp 10 Thời gian làm bài: 45 phút (không kể thời gian giao đề) |
Phần trắc nghiệm ( đáp án đúng là câu A)
Câu 1: Nguyên tử chứa những hạt mang điện là
A. proton và electron.
B. proton neutron và electron.
C. proton và neutron.
D. electron và neutron.
Câu 2: Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. Neutron, m 1 amu, q = 0.
B. Proton, m 0,00055 amu, q = +1.
C. Electron, m 1 amu, q = -1.
D. Proton, m 1 amu, q = -1.
Câu 3: Một cách gần đúng ta có thể coi khối lượng nguyên tử (tính theo đơn vị amu) bằng với giá trị của số khối. Vậy số khối của một nguyên tư được tính theo công thức nào sau đây?
A. A = Z + N.
B. A = Z - N.
C. A = Z + P.
D. A = Z – P.
Câu 4: Chọn phát biểu sai:
A. Các đồng vị phải có số electron khác nhau.
B. Các đồng vị phải có số neutron khác nhau.
C. Các đồng vị phải có cùng điện tích hạt nhân.
D. Các đồng vị phải có số khối khác nhau.
Câu 5: Nhóm các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học ?
Câu 6: Orbital nguyên tử là
A. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
B. đám mây chứa electron có dạng hình cầu.
C. đám mây chứa electron có dạng hình số 8 nổi.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
Câu 7: Sự chuyển động của electron theo quan điểm hiện đại được mô tả
A. Electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
B. Chuyển động của electron trong nguyên tử theo một quỹ đạo nhất định hình tròn hay hình bầu dục.
C. Electron chuyển động cạnh hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
D. Electron chuyển động rất chậm gần hạt nhân theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
Câu 8: Nguyên tử của một nguyên tố có bốn lớp electron, theo thứ tự từ phía gần hạt nhân ra xa dần là : K, L, M, N. Trong nguyên tử đã cho, electron thuộc lớp nào có mức năng lượng trung bình cao nhất ?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
Câu 9: Mỗi orbital nguyên tử chứa tối đa
A. 2 electron.
B. 1 electron.
C. 3 electron.
D. 4 electron.
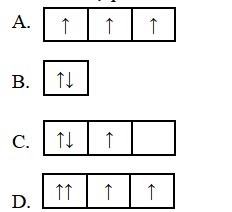
Câu 10: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 11: Xét về mức năng lượng, các electron trên cùng một phân lớp có mức năng lượng:
A. bằng nhau.
B. gần bằng nhau.
C. không bằng nhau.
D. có thể bằng nhau hoặc không.
Câu 12: Nhận định vê số phân lớp electron trên các lớp nào sau đây là sai?
A. Lớp K có 2 phân lớp.
B. Lớp L có hai phân lớp.
C. Lớp M có 3 phân lớp.
D. lớp N có 4 phân lớp.
Câu 13: Sắp xếp các phân lớp sau theo thứ tự phân mức năng lượng tăng dần nào sa đây là đúng:
A. 1s < 2s < 2p < 3s
B. 1s < 2s < 3p < 3s
C. 1s < 2s < 3s < 2p
D. 3s < 3p < 3d < 4s.
Câu 14: Nguyên tử sulfur (Z=16) ở trạng thái cơ bản sự phân bố electron vào các lớp từ trong ra ngoài lần lượt là
A. Lớp K có 2e; lớp L có 8e; lớp M có 6e.
B. Lớp K có 2e; lớp L có 6e; lớp M có 8e.
C. Lớp K có 2e; lớp L có 4e; lớp M có 6e; lớp N có 4e.
D. Lớp K có 2e; lớp L có 2e; lớp M có 6e; lớp N có 6e.
Câu 15: Các electron lớp ngoài cùng có vai trò quyết định đến tính chất hoá học đặc rưng của một nguyên tố. Dự đoán tính chất hoá học dựa vào số electron lớp ngoài cùng nào sau đây à sai?
A. Nguyên tử (X) có 8 electron lớp ngoài cùng nên (X) là phi kim.
B. Nguyên tử (Y) có 6 electron lớp ngoài cùng nên (Y) là phi kim.
C. Nguyên tử (A) có 1 electron lớp ngoài cùng nên (A) là kim loại.
D. Nguyên tử (B) có 7 electron lớp ngoài cùng nên (B) là phi kim.
Câu 16: Số orbital trên các phân lớp s, p, d, f lần lượt là:
A. 1,3,5,7.
B. 2,4,6,8.
C. 2,6,10,14.
D. 1,2,3,4.
Câu 17: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại ?
A. electron.
B. proton.
C. neutron.
D. neutron và electron.
Câu 18: Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử?
A. Kích thước hạt nhân rất nhỏ so với nguyên tử.
B. Hạt nhân có kích thước bằng một nửa nguyên tử.
C. Hạt nhân chiếm gần như toàn bộ kích thước nguyên tử.
D. Hạt nhân có kích thước bằng 2/3 kích thước nguyên tử.
.............
Câu 22: Nếu orbital chứa 2 electron (hai mũi tên ngược chiều nhau) thì electron đó gọi là
A, electron ghép đôi.
B. electron độc thân.
C. orbital trống.
D. orbital s.
Câu 23: Sự phân bố electron vào các lớp và phân lớp căn cứ vào yếu tố nào ?
A. mức năng lượng.
B. nguyên tử lượng tăng dần.
C. điện tích hạt nhân tăng dần.
D. sự bão hòa các lớp electron.
Câu 24: Lớp M (n=3) có số electron tối đa là
A. 18.
B. 8.
C. 9.
D. 32.
Câu 25: Cấu hình electron nào sau đây không đúng?
A. 1s22s22p63s23p34s2.
B. 1s22s22p63s2.
C. 1s22s22p63s23p5.
D. 1s22s22p5.
Câu 26: Nguyên tử Cl (Z = 17) có số electron ở lớp ngoài cùng là
A. 7.
B. 5.
C. 2.
D. 8.
Câu 27: Nguyên tố Potassium có Z = 20.Hãy cho biết Potassium thuộc loại nguyên tố gì sau đây?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d.
D. Nguyên tố f.
Câu 28: Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hoá học nào sau đây?
A. sulfur (Z = 16).
B. oxygen (Z = 8).
C. Fluorine (Z = 9).
D. Chlorine (Z = 17).
II. PHẦN TỰ LUẬN
Câu 29: (1đ) Nguyên tử của nguyên tố X có tổng số các loạ hạt là 52. Trong đó số hạt mang điện nhiều hơn không mang điện 16 hạt.
a) Hãy xác định số hiệu nguyên tử và số khối của nguyên tử X đó.
b) Viết kí hiệu nguyên tử của X.
Đáp án đề thi giữa kì 1 môn Hóa học 10
Xem thêm đáp án trong file tải về
Ma trận đề thi giữa kì 1 Hóa 10
Hình thức: trắc nghiệm (70%) + tự luận(30%)
|
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ nhận thức |
Tổng |
% tổng Điểm |
|||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
|||||||||||
|
Số CH |
Thời gian (phút) |
|||||||||||||
|
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
TN |
TL |
|||||
|
1 |
Chương Nguyên tử |
Thành phần cấu tạo nguyên tử |
2 |
1,5 |
2 |
2 |
1 |
4,5 |
1 |
6 |
4 |
3 |
45 |
22,5 |
|
Nguyên tố hóa học |
3 |
2,25 |
3 |
3 |
|
1 |
6 |
6 |
22,5 |
|||||
|
Mô hình nuyên tử và orbital nguyên tử |
5 |
3,75 |
3 |
3 |
|
|
|
|
8 |
2 |
20 |
|||
|
Lớp, phân lớp và cấu hình electron |
6 |
4,5 |
4 |
4 |
1 |
4,5 |
|
|
10 |
35 |
||||
|
Tổng |
16 |
12 |
12 |
12 |
2 |
9 |
2 |
12 |
28 |
4 |
45 |
|
||
|
Tỉ lệ % |
40% |
30% |
20% |
10% |
|
|
|
|
||||||
|
Tỉ lệ chung |
70% |
30% |
|
|
|
|||||||||
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA GIỮA KÌ 1
MÔN: Hóa học 10 – THỜI GIAN LÀM BÀI 45 PHÚT
|
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá |
Số câu hỏi theo các mức độ nhận thức |
Tổng |
|||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
|
||||
|
1 |
Nguyên tử |
Thành phần cấu tạo nguyên tử |
Nhận biết: - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm. (1) - Đơn vị kích thước, khối lượng nguyên tử. - Hạt nhân gồm các hạt proton và nơtron. - Kí hiệu, khối lượng và điện tích của electron, proton và nơtron. (2) Thông hiểu: - Khối lượng của electron nhỏ hơn nhiều so với khối lượng proton và nơtron. (17) - Kích thước của nguyên tử chủ yếu là kích thước của lớp vỏ. (18) Vận dụng: - Xác định số proton, electron, nơtron trong nguyên tử, phân tử. (29a) - Xác định khối lượng nguyên tử. (29b) Vận dụng cao: - Làm bài tập liên quan đến thành phần cấu tạo nguyên tử. (31) - So sánh khối lượng, kích thước của p, e, n với nguyên tử.
|
2
|
2 |
1 |
1 |
|
|
Nguyên tố hoá học |
Nhận biết: - số hiệu nguyên tử bằngg số p, bằng số e nguyên tố , Số khối bằng số Z+N.. (3) - Khái niệm về nguyên tố hoá học, khái niệm đồng vị, khái niệm nguyên tử khối. (4) + (5) Thông hiểu: - Nguyên tố hoá học bao gồm những nguyên tử có cùng số đơn vị điện tích hạt nhân. (19) - Kí hiệu nguyên tử Trong đó X là kí hiệu hoá học của nguyên tố, số khối (A) là tổng số hạt proton và số hạt nơtron. (20) - Đồng vị, nguyên tử khối và nguyên tử khối trung bình của một nguyên tố ( tính nguyên tử khối trung bình của nguyên tố có hai đồng vị khi biết phần trăm số nguyên tử mỗi đồng vị). (21) Vận dụng: - Xác định số electron, số proton, số nơtron, số khối, điện tích hạt nhân khi biết kí hiệu nguyên tử và ngược lại. - Tính nguyên tử khối trung bình của nguyên tố có nhiều đồng vị. Vận dụng cao: - Tính phần trăm các đồng vị. - Tính số nguyên tử, phần trăm của một đồng vị trong một lượng chất xác định. (32) - Tính nguyên tử khối trung bình trong bài Hóa học phức tạp. |
3
|
3
|
|
1 |
|
||
|
Mô hình nguyên tử và orbital nguyên tử |
Nhận biết: - Nêu được các nội dung của mô hình nguyên tử theo Rutherford – bohr và mô hình hiện đại. - Các electron chuyển động rất nhanh xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định, tạo nên vỏ nguyên tử. (7) - Trong nguyên tử, các electron có mức năng lượng gần bằng nhau được xếp vào một lớp (K, L, M, N). (8) - Các electron trong mỗi phân lớp có mức năng lượng bằng nhau. (9) - nêu được khái niệm orbital nguyên tử, hình dạng của các AO (6) , số lượng electron trong một AO (10) Thông hiểu: - thế nào là elecron độc thân, electron ghép đôi(23) - Ở trạng thái cơ bản, trong nguyên tử các electron lần lượt chiếm các mức năng lượng từ thấp đến cao và sắp xếp thành từng lớp. (22) - so sánh được sự khác nhau giữa mô hình nguyên tử theo Rutherford – bohr và mô hình hiện đại. - Tính được Số electron tối đa trong mỗi lớp = 2n2 (24) Vận dụng: - Xác định được thứ tự các lớp electron trong nguyên tử, và biểu diễn được sự phân bố các electron trên mỗi lớp trong nguyên tử cụ thể.
|
5
|
3 |
|
|
|
||
|
Lớp – phân lớp và Cấu hình electron nguyên tử |
Nhận biết: - Khái niệm lớp , phân lóp electron (11) - Một lớp electron bao gồm một hay nhiều phân lớp. (12) - Thứ tự các mức năng lượng của các electron trong nguyên tử. (13) - Sự phân bố electron trên các phân lớp, lớp và cấu hình electron nguyên tử của 20 nguyên tố đầu tiên. (14) - Đặc điểm của lớp electron ngoài cùng: Lớp ngoài cùng có nhiều nhất là 8 electron (ns2np6), lớp ngoài cùng của nguyên tử khí hiếm có 8 electron (riêng heli có 2 electron). (15) - Hầu hết các nguyên tử kim loại có 1, 2, 3 electron ở lớp ngoài cùng. - Hầu hết các nguyên tử phi kim có 5, 6, 7 electron ở lớp ngoài cùng. - Số orbital trong mỗi lớp, mỗi phân lớp (16) Thông hiểu: - Quy ước viết cấu hình electron của nguyên tử (25) - Xác định số electron lớp ngoài cùng. (26) - Xác định loại nguyên tố s, p, d dựa vào cấu hình electron nguyên tử. (27) - Hiểu được cách phân bố electron vào các lớp thứ 1, 2, 3. - Hiểu được cách phân bố electron vào các phân lớp. (28) - Số electron tối đa trong một lớp, một phân lớp. - Số phân lớp (s, p, d) trong một lớp, trong nguyên tử Vận dụng: - Viết được cấu hình electron nguyên tử của một số nguyên tố hoá học có Z≤20 (30a) - Dựa vào cấu hình electron lớp ngoài cùng của nguyên tử suy ra tính chất hoá học cơ bản (là kim loại, phi kim hay khí hiếm) của nguyên tố tương ứng. (30b) - biểu diễn được cấu hình electron theo ô orbital. (30c) Vận dụng cao: - Viết được cấu hình electron nguyên tử của những nguyên tố có Z>20 |
6
|
4
|
1 |
|
|
||
|
Tổng |
|
16 |
12 |
2 |
2 |
|
||
|
Tỉ lệ % từng mức độ nhận thức |
|
40% |
30% |
20% |
10% |
|
||
|
Tỉ lệ chung |
|
70% |
30% |
|||||
...............
3. Đề thi giữa kì 1 môn Hóa học 10 Cánh diều
|
SỞ GIÁO DỤC VÀ ĐÀO TẠO . …. (Đề có 02 trang) |
ĐỀ KIỂM TRA GIỮA HỌC KỲ 1 NĂM HỌC 20… – 20… Môn: HOÁ HỌC – Lớp 10 Thời gian làm bài: 45 phút (không kể thời gian giao đề) |
I. Phần trắc nghiệm ( 3,0 điểm).
Câu 1: Trong nguyên tử, hạt mang điện là
A. electron
B. electron và nơtron
C. proton và nơtron.
D. proton và electron
Câu 2: Một nguyên tử được đặc trưng cơ bản bằng
A. Số khối A và số nơtron
B. Số proton và số electron
C. Số proton và điện tích hạt nhân
D. Số khối A và điện tích hạt nhân
Câu 3: Nguyên tử X có Z = 11, N = 12, E = 11. Kí hiệu nguyên tử đúng của nguyên tử A là:
Câu 4: Phát biểu nào sau đây là đúng :
A. Nguyên tử là phần tử nhỏ nhất của chất không mang điện.
B. Nguyên tử là phần tử nhỏ nhất của chất mang điện tích dương.
C. Nguyên tử là phần tử nhỏ nhất của chất mang điện tích âm.
D. Nguyên tử là phần tử nhỏ nhất của chất có thể mang điện hoặc không mang điện.
Câu 5: Các electron thuộc các lớp K, L, M, N trong nguyên tử khác nhau về:
A. Đường chuyển động của các electron.
B. Độ bền liên kết với hạt nhân.
C. Năng lượng trung bình của các electron.
D. Độ bền liên kết với hạt nhân và năng lượng trung bình của các electron.
Câu 6 : Kí hiệu của 2 nguyên tử Clo là: và . Tìm câu trả lời sai
A. Hai nguyên tử trên là đồng vị của nhau.
B. Hai nguyên tử trên có cùng số electron.
C. Hai nguyên tử trên có cùng số khối
D. Hai nguyên tử trên có cùng số hiệu nguyên tử
Câu 7: Nguyên tố bạc có 2 đồng vị bền là 107Ag chiếm 56% về nguyên tử và 109Ag. Nguyên tử khối trung bình của bạc là:
A. 107,88
B. 107
C. 109,77
D. 109
Câu 8: Các nguyên tố trong bảng tuần hoàn do Men- đê - lê - ép công bố được sắp xếp theo chiều tăng dần
A. khối lượg nguyên.
B. bán kính nguyên tử.
C. số hiệu nguyên tử.
D. độ âm điện của nguyên tử.
Câu 9: Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 34, biết số notron nhiều hơn số proton là 1. Số hiệu nguyên tử là?
A. 11
B. 19
C. 21
D. 23
Câu 10: Nguyên tử của nguyên tố X có 10p, 10n và 10e. Trong bảng HTTH, X ở
A. chu kì 2 và nhóm VA.
B. chu kì 2 và nhóm VIIIA.
C. chu kì 3 và nhóm VIIA.
D. chu kì 3 và nhóm VA.
Câu 11: Nguyên tố X có Z= 25 thuộc khối nguyên tố?
A. s.
B. p.
C. d.
D. f.
Câu 12: Cấu hình e của nguyên tử nhôm (Z=13): 1s22s22p63s23p1. Phát biểu nào sai?
A. Lớp thứ nhất ( lớp K ) có 2e.
B. Lớp thứ hai ( lớp L) có 8e.
C. Lớp thứ ba (lớp M) có 3e.
D. Lớp ngoài cùng có 1e.
Phần 2: Chọn đúng sai
Câu 1. X là nguyên tố phổ biến thứ 4 trong vỏ trái đất, X có trong hemoglobin của máu làm nhiệm vụ vận chuyển oxygen, duy trì sự sống. Nguyên tử X có 26 proton, số khối là 56 trong hạt nhân.
A. X có 26 neutron trong hạt nhân.
B. X có 26 electron ở vỏ nguyên tử.
C. X có điện tích hạt nhân là + 26.
D. Khối lượng nguyên tử X là 26 amu.
Câu 2. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X và Y lần lượt là:
A. Tổng số electron lớp ngoài cùng của X và Y bằng 8.
B. X là nguyên tố phi kim.
C. Nitrogen (Z = 7) có cùng số electron lớp ngoài cùng với X.
D. Y là nguyên tố khí hiếm.
Phần II: Tự luận (5,0 điểm)
Câu 1: Hãy cho biết các nguyên tố 17A, 20B.
a. Viết cấu hình electron và xác định vị trí của chúng trong bảng hệ thống tuần hoàn? Giải thích?
............
Tải file tài liệu để xem thêm đề thi giữa kì 1 Hóa học 10 Cánh diều
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:












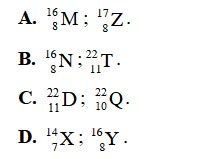
 Toán 10 Kết nối tri thức
Toán 10 Kết nối tri thức
 Toán 10 Chân trời sáng tạo
Toán 10 Chân trời sáng tạo
 Toán 10 Cánh Diều
Toán 10 Cánh Diều
 Soạn văn 10 Chân trời sáng tạo
Soạn văn 10 Chân trời sáng tạo
 Soạn văn 10 Cánh Diều
Soạn văn 10 Cánh Diều
 Soạn văn 10 Kết nối tri thức
Soạn văn 10 Kết nối tri thức
 Tiếng Anh 10 Global Success
Tiếng Anh 10 Global Success
 Tiếng anh 10 Friends Global
Tiếng anh 10 Friends Global
 Tiếng Anh 10 Explore New Worlds
Tiếng Anh 10 Explore New Worlds