Lý thuyết Khoa học tự nhiên 8 Kết nối tri thức với cuộc sống Trọn bộ lí thuyết KHTN 8
Lý thuyết môn Khoa học tự nhiên 8 Kết nối tri thức với cuộc sống là tài liệu vô cùng hữu ích mà Eballsviet.com muốn giới thiệu đến quý thầy cô cùng các bạn học sinh tham khảo.
Tổng hợp kiến thức lý thuyết KHTN lớp 8 Kết nối tri thức được biên soạn toàn bộ lý thuyết của 47 bài học có trong chương trình sách giáo khoa mới. Thông qua tài liệu này giúp học sinh dễ dàng soạn và làm bài tập Khoa học tự nhiên 8. Đồng thời đây cũng là tài liệu tự học ở nhà rất tốt với các bạn học sinh. Bên cạnh lí thuyết KHTN 8 các bạn xem thêm Bài tập trắc nghiệm Khoa học tự nhiên 8 sách Kết nối tri thức với cuộc sống.
Lý thuyết KHTN 8 Kết nối tri thức
Bài 1: Sử dung một số hóa chất, thiết bị cơ bản trong phòng thí nghiệm
I. Nhận biết hoá chất và quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm
1. Nhận biết hoá chất
- Nhận biết hoá chất: Các hoá chất được đựng trong chai hoặc lọ kín và có dán nhãn ghi đầy đủ thông tin, bao gồm tên, công thức, trọng lượng hoặc thể tích, độ tinh khiết, nhà sản xuất, cảnh báo và điều kiện bảo quản. Các dụng dịch cần ghi rõ nồng độ của chất tan.
2. Quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm
- Không sử dụng hoá chất không có nhãn hoặc nhãn mờ. Đọc kĩ nhãn hoá chất và tìm hiểu tính chất, lưu ý, cảnh báo của mỗi loại hoá chất trước khi sử dụng.
- Không lấy hoá chất bằng tay trực tiếp, sử dụng các dụng cụ thích hợp như thìa, panh, phễu, cốc... tùy từng trường hợp.
- Không đặt lại các dụng cụ vào lọ đựng hoá chất sau khi sử dụng.
II. Giới thiệu một số dụng cụ thí nghiệm và cách sử dụng
1. Một số dụng cụ thí nghiệm thông dụng

2. Cách sử dụng một số dụng cụ thí nghiệm
- Ống nghiệm:
+ Khi thực hiện thí nghiệm, giữ ống nghiệm bằng tay không thuận, dùng tay thuận để thêm hoá chất vào ống nghiệm.
+ Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng 1/3 ống nghiệm tính từ miệng ống. Từ từ đưa đáy ống nghiệm vào ngọn lửa đèn cồn, miệng ống nghiêng về phía không có người, làm nóng đều đáy ống nghiệm rồi mới đun trực tiếp tại nơi có hoá chất. Điều chỉnh đáy ống nghiệm vào vị trí nóng nhất của ngọn lửa (khoảng 2/3 ngọn lửa từ dưới lên), không để đáy ống nghiệm sát vào bấc đèn cồn.
- Ống hút nhỏ giọt:
+ Ống hút nhỏ giọt thường có quả bóp cao su để lấy chất lỏng với lượng nhỏ.
+ Khi lấy chất lòng, bóp chặt và giữ quả bóp cao su, đưa ống hút nhỏ giọt vào lọ đựng hoá chất, thả chậm quả bóp cao su để hút chất lỏng lên.
+ Chuyển ống hút nhỏ giọt đến ống nghiệm và bóp nhẹ quả bóp cao su để chuyển từng giọt dung dịch vào ống nghiệm. Không chạm đầu ống hút nhỏ giọt vào thành ống nghiệm.
III. Giới thiệu một số thiết bị và cách sử dụng
1. Thiết bị đo pH
- Cách sử dụng thiết bị đo pH: cho điện cực của thiết bị vào dung dịch cần đo pH. giá trị pH của dung dịch sẽ xuất hiện trên thiết bị đo.
2. Huyết áp kế
- Huyết áp kế dùng để đo huyết áp gồm huyết áp kế đồng hồ, huyết áp kế thuỷ ngân..
3. Thiết bị diện và cách sử dụng
a) Thiết bị cung cấp điện (nguồn điện)
- Các thí nghiệm về điện ở môn Khoa học tự nhiên thường dùng nguồn điện là pin 1,5 V. Để có bộ nguồn 3 V thì dùng hai pin, để có bộ nguồn 6 V thì dừng bán pin.
b) Biến áp nguồn
- Biến áp nguồn là thiết bị có chức năng chuyển đổi điện áp xoay chiều có giá trị 220 V thành điện áp xoay chiều (AC) hoặc điện áp một chiều (DC) có giá trị nhỏ, đảm bảo an toàn khi tiến hành thí nghiệm
c) Thiết bị đo điện
- Thiết bị đo điện bao gồm ampe kế và vôn kế, trong đó ampe kế đo cường độ dòng điện và vôn kế đo hiệu điện thế. Cần chú ý kết nối chốt âm và chốt dương ứng với các thang đo của thiết bị, và lựa chọn thang đo hợp lí để đảm bảo không vượt quá giá trị tối đa.
d) Joulemeter
- Joulemeter là thiết bị đo dòng điện, điện áp, công suất và năng lượng điện cung cấp cho mạch điện. Các giá trị đo được hiển thị trên màn hình LED.
e) Thiết bị sử dụng điện
- Biến trở
- Đèn phát quang (kèm điện trở bảo vệ)
- Bóng đèn pin kèm đa 3V
- Khi sử dụng đèn phát quang (LED), cần kết nối cực dương (+) với cực dương của nguồn điện và cực âm (-) với cực âm của nguồn điện. Để đèn LED không bị hỏng, cần mắc nối tiếp với đèn một điện trở có giá trị thích hợp.
g) Thiết bị điện hỗ trợ
- Công tắc
- Cầu chì ống
Bài 2: Phản ứng hóa học
I. Biến đổi vật lí và biến đổi hoá học
- Thí nghiệm về sự chuyển thể của nước
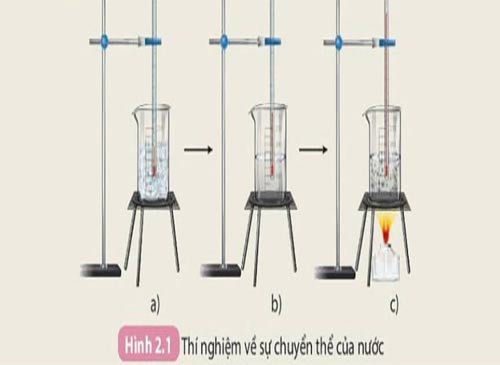
Hình 2.1 hướng dẫn cách thực hiện thí nghiệm về sự chuyển thể của nước bằng cách sử dụng nước đá viên, cốc thuỷ tinh 250mL, nhiệt kế, đèn cồn, miếng sắt.
- Các quá trình như hoà tan, đông đặc, nóng chảy... chỉ là các quá trình chuyển đổi giữa các trạng thái của chất mà không tạo ra chất mới, đó là biến đổi vật lí.
Thí nghiệm về biến đổi hoá học:
- Chuẩn bị: bột sắt (Fe) và bột lưu huỳnh (S) theo tỉ lệ 7 : 4 về khối lượng; ống nghiệm chịu nhiệt, đèn cồn, đũa thuỷ tinh, thỏa thuỷ tinh.
- Tiến hành:
+ Trộn đều hỗn hợp bột sắt và bột lưu huỳnh. Lần lượt cho vào hai ống nghiệm (1) và (2) mỗi ống 3 thìa hỗn hợp.
+ Đưa nam châm lại gần ống nghiệm (1), quan sát hiện tượng.
+ Đun nóng mạnh đáy ống nghiệm (2) khoảng 30 giây rồi ngưng đun. Để nguội và đưa nam châm lại gần ống.
=> Các quá trình như đốt cháy nhiên liệu, phân huỷ chất (ví dụ: nung đá vôi,...), tổng hợp chất (ví dụ: quá trình quang hợp...) có sự tạo thành chất mới, đó là biến đổi hóa học. Trong cơ thể người và động vật, sự trao đổi chất là một loạt các quá trình sinh hoá, bao gồm cả biến đổi vật lí và biến đổi hoá học.
II. Phản ứng hoá học
- Diễn biến phản ứng hoá học:
+ Trong phản ứng hoá học, xảy ra sự phá vỡ các liên kết trong phân tử chất đầu, hình thành các liên kết mới, tạo ra các phân tử mới. Kết quả là chất này biến đổi thành chất khác. Ví dụ: Phản ứng giữa hydrogen và oxygen tạo thành nước được mô tả như sau:
- Hiện tượng kèm theo các phản ứng hoá học:
+ Phản ứng hoá học xảy ra khi có chất mới được tạo thành với những tính chất mới, khác biệt với chất ban đầu. Những dấu hiệu dễ nhận ra có chất mới tạo thành là sự thay đổi về màu sắc, xuất hiện chất khí hoặc xuất hiện chất kết tủa...
+ Sự toả nhiệt và phát sáng cũng là dấu hiệu cho biết phản ứng hoá học đã xảy ra
+ Dấu hiệu nhận biết có chất mới tạo thành
III. Năng lượng của phản ứng hoá học
1.Phản ứng toả nhiệt, phản ứng thu nhiệt
- Phản ứng toả nhiệt giải phóng năng lượng (dạng nhiệt) ra môi trường xung quanh.
- Phản ứng thu nhiệt nhận năng lượng (dạng nhiệt) trong suốt quá trình phản ứng xảy ra.
2. Ứng dụng của phản ứng toả nhiệt
- Các phản ứng toả nhiệt có vai trò quan trọng trong cuộc sống vì chúng cung cấp năng lượng cho sinh hoạt và sản xuất, vận hành động cơ, thiết bị máy công nghiệp, phương tiện giao thông.
...........
Bài 3: Mol và tỉ khối chất khí
I. Mol
1. Khái niệm
- Khái niệm: Trong khoa học, khối lượng nguyên tử carbon được quy ước là đơn vị khối lượng 1/12 nguyên tử (amu).
- Khối lượng 1 nguyên tử carbon là 12 amu và khối lượng này rất nhỏ.
- Số Avogadro (Ng) là số nguyên tử trong 12 gam carbon và có giá trị là 6,022x10²³.
2. Khối lượng mol
- (M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
- Khối lượng mol (g/mol) và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
3. Thể tích mol của chất khí
- Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khi đó và ở cùng điều kiện nhiệt độ và áp suất, hai bình khí có thể tích bằng nhau có cùng số mol khí.
- Ở điều kiện chuẩn (25 °C và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lit.
- Thể tích mol của a mol khi ở điều kiện chuẩn là V = 24,79 (L).
II. Tỉ khối chất khí
- Để xác định khí A nặng hơn hay nhẹ hơn khí B bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A (MA) và khối lượng mol của khí B (MB). Tỉ số này được gọi là tỉ khối của khÍ A đối với khÍ B, được biểu diễn bằng công thức: dA/B = MA/MB.
- Để xác định một khi A nặng hơn hay nhẹ hơn không khí bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A và "khối lượng mol" của không khí:
- Coi không khí gồm 20% oxygen và 80% nitrogen về thể tích. Vậy trong 1 mol không khí có 0,2 mol oxygen và 0,8 mol nitrogen. Khối lượng mol của không khí là: Mkk= 0,2×32 + 0,8×28 = 28.8 (g/mol).
Tỉ khối của khí A so với không khí là: d = m/Mkk.
Tải file tài liệu để xem thêm trọn bộ lí thuyết KHTN 8 Kết nối tri thức
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:












 Toán 8 Kết nối tri thức
Toán 8 Kết nối tri thức
 Toán 8 Cánh Diều
Toán 8 Cánh Diều
 Toán 8 Chân trời sáng tạo
Toán 8 Chân trời sáng tạo
 Toán 8
Toán 8
 Soạn Văn 8 Kết nối tri thức
Soạn Văn 8 Kết nối tri thức
 Soạn văn 8 Chân trời sáng tạo
Soạn văn 8 Chân trời sáng tạo
 Soạn Văn 8 Cánh Diều
Soạn Văn 8 Cánh Diều
 Chuyên đề Ngữ văn 8
Chuyên đề Ngữ văn 8
 Văn mẫu 8 Kết nối tri thức
Văn mẫu 8 Kết nối tri thức
 Văn mẫu 8 Chân trời sáng tạo
Văn mẫu 8 Chân trời sáng tạo









