Hoá học 10 Bài 3: Nguyên tố hóa học Giải Hoá lớp 10 trang 16
Giải Hóa 10 Bài 3: Nguyên tố hóa học là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Cánh diều trang 16, 17, 18, 19, 20.
Hóa 10 bài 3: Nguyên tố hóa học được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 bài 3 trang 16 sách Cánh diều, mời các bạn cùng theo dõi tại đây.
Giải Hoá 10 Bài 3: Nguyên tố hóa học
Trả lời câu hỏi và thảo luận Hóa 10 bài 3 Cánh diều
Câu 1
Nguyên tử lithium (Li) có 3 proton trong hạt nhân. Khi Li tác dụng với khí chlorine (Cl2) sẽ thu được muối lithium chlorine (LiCl), trong đó Li tồn tại ở dạng Li+. Ion Li+ có bao nhiêu proton trong hạt nhân?
Gợi ý đáp án
Nguyên tử Li và ion Li+ đều thuộc cùng 1 nguyên tố hóa học là Li
Li+ là nguyên tử Li sau khi mất đi 1 electron. Do vậy Li+ sẽ có 3 proton và 2 electron
=> Trong hạt nhân Li và Li+ đều có cùng số hạt proton là 3.
Câu 2
Một loại nguyên tử Lithium có 3 proton, 4 neutron. Viết kí hiệu nguyên tử của Lithium đó.
Gợi ý đáp án
Nguyên tử Li có 3 proton và 4 neutron
Số hiệu nguyên tử Z = số proton (p)
Số khối A = p + n
=> Số hiệu nguyên tử của Li là 3 và số khối của Li = 3 + 4 = 7
=> Kí hiệu nguyên tử của Lithium đó: ![]() \(_{3}^{7}Li\)
\(_{3}^{7}Li\)
Câu 3
Cho các nguyên tử sau:
![]() \(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\)
\(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\)
Những nguyên tử nào là đồng vị của nhau?
Gợi ý đáp án
Trong các nguyên tử: ![]() \(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\). Chỉ có nguyên tử M và T là có số hiệu nguyên tử (số proton) bằng nhau.
\(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\). Chỉ có nguyên tử M và T là có số hiệu nguyên tử (số proton) bằng nhau.
Vậy nguyên tử M và T là đồng vị của nhau.
Giải bài tập Hóa 10 bài 3 trang 16
Bài 1
Hoàn thành bảng sau đây
| Kí hiệu | Số hiệu nguyên tử | Số khối | Số proton | Số electron | Số neutron |
| ? | ? | ? | ? | ? | |
| ? | ? | 39 | 19 | ? | ? |
| ? | 16 | ? | ? | ? | 20 |
Gợi ý đáp án
| Kí hiệu | Số hiệu nguyên tử | Số khối | Số proton | Số electron | Số neutron |
| 18 | 40 | 18 | 18 | 22 | |
| 19 | 39 | 19 | 19 | 20 | |
| 16 | 36 | 16 | 16 | 20 |
Bài 2
Những phát biểu nào sau đây là đúng?
(a) Những nguyên tử có cùng số electron thì thuộc cùng một nguyên tố hóa học
(b) Hai ion dương (ion một nguyên tử) có điện tích lần lượt là +2 và +3, đều có 26 proton. Vậy hai ion này thuộc cùng một nguyên tố hóa học
(c) Hai nguyên tử A và B đều có số khối là 14. Vậy hai nguyên tử này thuộc cùng một nguyên tố hóa học.
(d) Những nguyên tử có cùng số neutron thì thuộc cùng một nguyên tố hóa học.
Gợi ý đáp án
a) Đúng vì:
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
- Tất cả nguyên tử của cùng 1 nguyên tố hóa học đều có cùng số proton và cùng số electron.
b) Đúng vì:
Hai ion đều có 26 proton hay đều có số hiệu nguyên tử = 26 => Hai ion dương này đều thuộc cùng 1 nguyên tố hóa học
c) Sai vì: nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
d) Sai vì: nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
Bài 3
Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng
Gợi ý đáp án
Ta có: nCu = 6,354 : 63,54 = 0,1 (mol)
Gọi tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là a
=> Tỉ lệ phần trăm của đồng vị 65Cu trong tự nhiên là 100 – a
Nguyên tử khối trung bình của Cu là 63,54
=> ![]() \(\frac{63.a + 65.(100 − a)}{100} = 63,54\)
\(\frac{63.a + 65.(100 − a)}{100} = 63,54\)
=> x = 73
=> Tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là 73%
=> Trong 0,1 mol Cu sẽ có 0,1. 73% = 0,073 mol 63Cu
=> Trong 0,1 mol Cu sẽ có 0,1 - 0,073 = 0,022 mol 65Cu
Bài 4
Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở Hình 3.5.
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1).
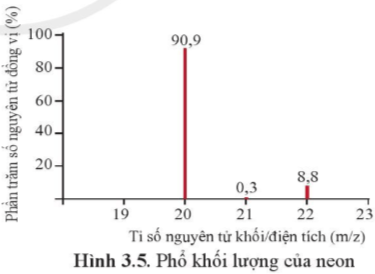
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của Neon.
Gợi ý đáp án
a) Neon có 3 đồng vị bền:
+ Đồng vị 20Ne chiếm 90,9%
+ Đồng vị 21Ne chiếm 0,3%
+ Đồng vị 22Ne chiếm 8,8%
b) Công thức tính nguyên tử khối trung bình:
=> ![]() \(M_{Ne} =\frac{ 90,9.20+0,3.21+8,8.22}{100} = 20,18\)
\(M_{Ne} =\frac{ 90,9.20+0,3.21+8,8.22}{100} = 20,18\)
Vậy nguyên tử khối trung bình của Neon là 20,18
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:













 Toán 10 Kết nối tri thức
Toán 10 Kết nối tri thức
 Toán 10 Chân trời sáng tạo
Toán 10 Chân trời sáng tạo
 Toán 10 Cánh Diều
Toán 10 Cánh Diều
 Soạn văn 10 Chân trời sáng tạo
Soạn văn 10 Chân trời sáng tạo
 Soạn văn 10 Cánh Diều
Soạn văn 10 Cánh Diều
 Soạn văn 10 Kết nối tri thức
Soạn văn 10 Kết nối tri thức
 Tiếng Anh 10 Global Success
Tiếng Anh 10 Global Success
 Tiếng anh 10 Friends Global
Tiếng anh 10 Friends Global
 Tiếng Anh 10 Explore New Worlds
Tiếng Anh 10 Explore New Worlds








