Chuyên đề Định luật bảo toàn khối lượng Phương pháp và các dạng bài tập bảo toàn khối lượng
Chuyên đề Định luật bảo toàn khối lượng là tài liệu vô cùng hữu ích mà Eballsviet.com muốn giới thiệu đến quý thầy cô cùng các bạn học sinh lớp 12 tham khảo.
Tài liệu bao gồm toàn bộ kiến thức lý thuyết, phương pháp, ví dụ và các dạng bài tập về bảo toàn khối lượng. Qua tài liệu này giúp các bạn có thêm nhiều tư liệu tham khảo, trau dồi kiến thức để giải nhanh Hóa học 12. Bên cạnh đó các bạn tham khảo thêm Tổng hợp công thức Hóa học lớp 12.
Chuyên đề Định luật bảo toàn khối lượng
A. Phương pháp bảo toàn khối lượng
Vào khoảng đầu những năm 50 của thế kỷ XVIII, nhà bác học vĩ đại người Nga M.V Lômônôxốp (1711-1765) và Lavoadie (A.Lavoisier) người Pháp là những người đầu tiên phát hiện ra ĐLBTKL: “Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất tham gia”. Qua hơn 100 năm sau, định luật đã được hai nhà bác học là Stat kiểm tra lại vào những năm 1860-1870; Landon vào năm 1909 sử dụng cân với đọ chính xác 0,00001g.
1.1 Nội dung của định luật:
Trong phản ứng hóa học thì tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các chất tạo thành sau phản ứng ( không tính khối lượng của phần không tham gia phản ứng).
1.2. Kinh nghiệm áp dụng định luật:
- Áp dụng định luật bảo toàn khối lượng khi một phản ứng hoá học có n chất mà ta biết được khối lượng của (n - 1) chất (kể cả chất phản ứng và sản phẩm).
- Khi áp dụng định luật bảo toàn khối lượng cho một phản ứng thì phản ứng đó không cần cân bằng mà chỉ cần quan tâm chất tham gia phản ứng và sản phẩm thu được.
1.3. Công thức của định luật:
Xét phản ứng: A + B → C + D (1)
Áp dụng định luật bảo toàn khối lượng cho pứ (1) có:
mA + mB = mC + mD
Trong đó: mA, mB lần lượt là phần khối lượng tham gia phản ứng của chất A, B mC, mD lần lượt là khối lượng được tạo thành của chất C, D
Hệ quả 1: Biết tổng khối lượng chất ban đầu « khối lượng chất sản phẩm
Phương pháp giải: m(đầu) = m(sau) (không phụ thuộc hiệu suất phản ứng)
Hệ quả 2: Trong phản ứng có n chất tham gia, nếu biết khối lượng của (n – 1) chất thì ta dễ dàng tính khối lượng của chất còn lại.
Hệ quả 3: Bài toán: Kim loại + axit → muối + khí
- Biết khối lượng kim loại, khối lượng anion tạo muối (tính qua sản phẩm khí) → khối lượng muối
- Biết khối lượng muối và khối lượng anion tạo muối → khối lượng kim loại
- Khối lượng anion tạo muối thường được tính theo số mol khí thoát ra:
- Với axit HCl và H2SO4 loãng
+ 2HCl → H2 nên 2Cl- ↔H2
+ H2SO4 → H2 nên SO42- ↔ H2
- Với axit H2SO4đặc, nóng và HNO3: Sử dụng phương pháp ion – electron (xem thêm phương pháp bảo toàn electron hoặc phương pháp bảo toàn nguyên tố)
Hệ quả 3: Bài toán khử hỗn hợp oxit kim loại bởi các chất khí (H2, CO)
Sơ đồ: Oxit kim loại + (CO, H2) → rắn + hỗn hợp khí (CO2, H2O, H2, CO)
1.5. Đánh giá phương pháp bảo toàn khối lượng.
Phương pháp bảo toàn khối lượng cho phép giải nhanh được nhiều bài toán khi biết quan hệ về khối lượng của các chất trước và sau phản ứng.
Đặc biệt, khi chưa biết rõ phản ứng xảy ra hoàn toàn hay không hoàn toàn thì việc sử dụng phương pháp này càng giúp đơn giản hóa bài toán hơn.
Phương pháp bảo toàn khối lượng thường được sủ dụng trong các bài toán nhiều chất.
1.6. Các bước giải.
Lập sơ đồ biến đổi các chất trước và sau phản ứng.
Từ giả thiết của bài toán tìm  \(\sum_{\text {trưćc }}^{\mathrm{m}}=\sum_{\text {sau }}^{\mathrm{m}}\)(không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
\(\sum_{\text {trưćc }}^{\mathrm{m}}=\sum_{\text {sau }}^{\mathrm{m}}\)(không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
- Vận dụng định luật bảo toàn khối lượng để lập phương trình toán học, kết hợp dữ kiện khác để lập hệ phương trình toán.
- Giải hệ phương trình.
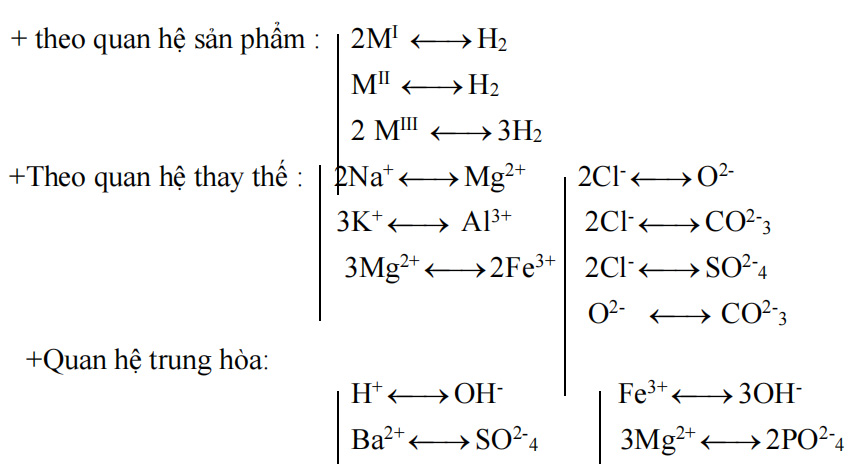
1.7.Lưu ý: Ta lập các sơ đồ liên hệ
* Ví dụ 1: Cho m gam FexOy tác dụng với dd H2SO4 đặc nóng vừa đủ, có chứa 0,075 mol H2SO4 , thu được dung dịch X và 0,672 lít SO2 (đktc) duy nhất thoát ra. Cô cạn dung dịch X thu được 9 gam muối khan. Tính m
Giải
FexOy + H2SO4 → Fe2(SO4)3 + SO2 + H2O (1)
Áp dụng định luật bảo toàn khối lượng cho phản ứng (1) ta được:
mFexOy + mHSO = mFe(SO) + mSO + mHO
→ m + 0,075.98 = 9 + 0,03. 64 + 0,075.18
→ m = 4,92g
.................
Mời các bạn tải File tài liệu để xem thêm nội dung chi tiết
Chọn file cần tải:
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:













 Đề thi học kì 1 Lớp 12
Đề thi học kì 1 Lớp 12
 Đề thi giữa học kì 1 Lớp 12
Đề thi giữa học kì 1 Lớp 12
 Đề thi giữa học kì 2 Lớp 12
Đề thi giữa học kì 2 Lớp 12
 Đề thi học kì 2 Lớp 12
Đề thi học kì 2 Lớp 12
 Soạn Văn 12 KNTT
Soạn Văn 12 KNTT
 Soạn Văn 12 CTST
Soạn Văn 12 CTST
 Soạn Văn 12 Cánh Diều
Soạn Văn 12 Cánh Diều
 Văn 12
Văn 12
 Toán 12 Chân trời sáng tạo
Toán 12 Chân trời sáng tạo