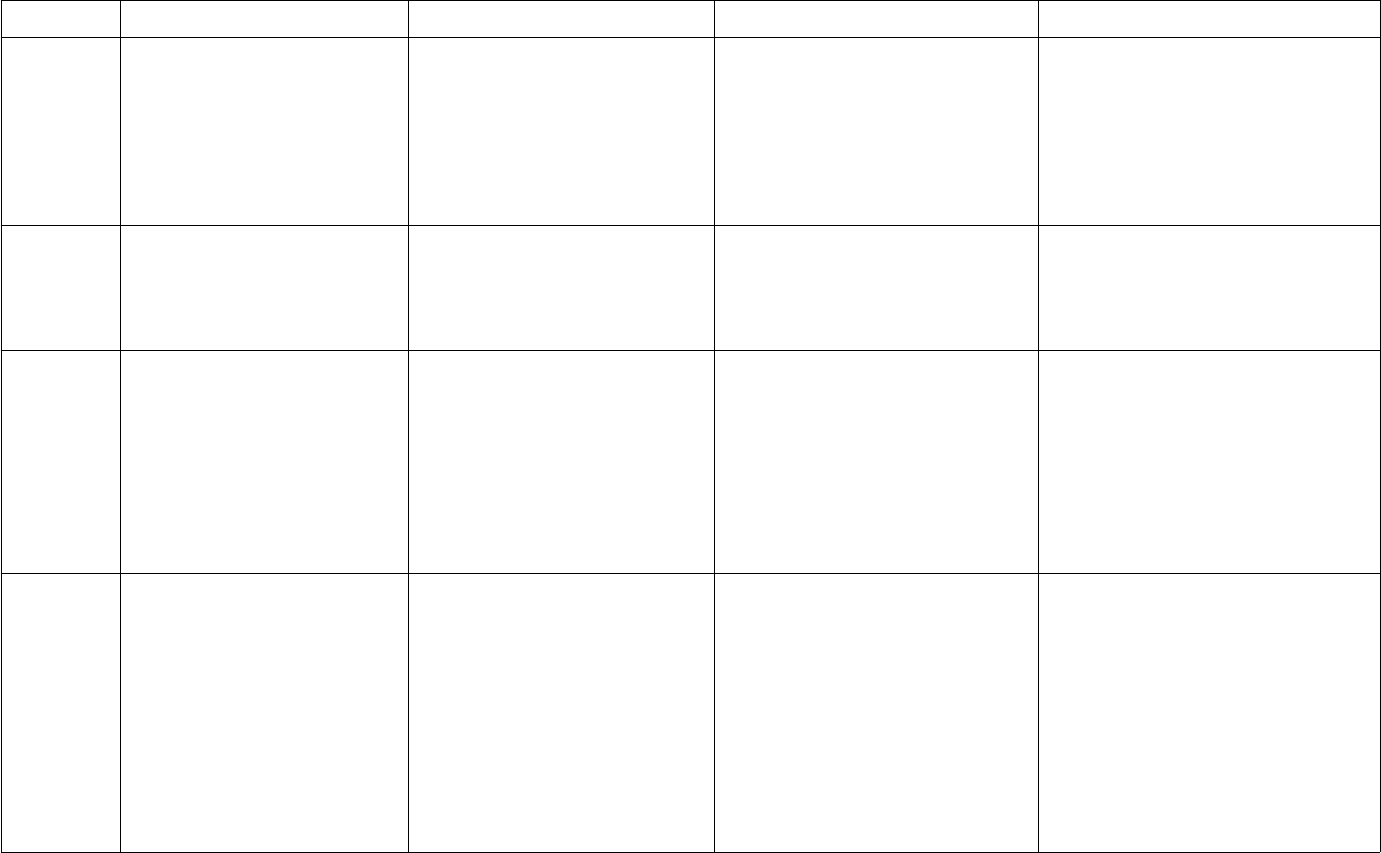
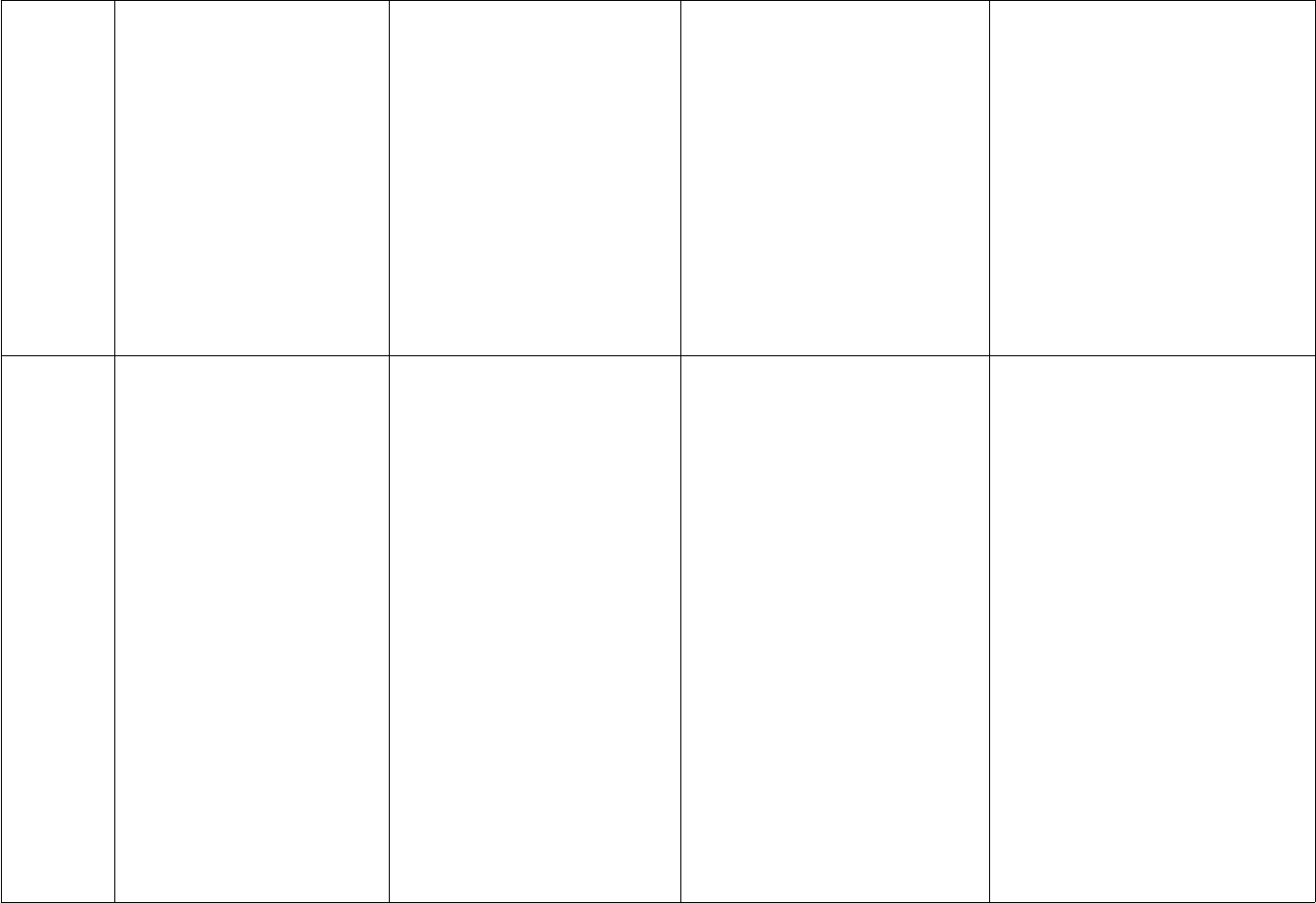
Bảng hệ thống hóa các loại hợp chất vô cơ Tài liệu học tập môn Hóa lớp 9
Bảng hệ thống hóa các loại hợp chất vô cơ là tài liệu hóa học dành cho các bạn học sinh lớp 9 muốn hệ thống hóa lại kiến thức của mình một cách khoa học, bài bản.
Bảng hệ thống hóa các loại hợp chất vô cơ được biên soạn một cách chính xác, có hệ thống giúp cho người học nắm vững được những kiến thức căn bản như oxit, axit, bazo, muối xoay quanh khái niệm, tính chất tổng quát và phân loại. Đây là những kiến thức cần thiết, nắm vững bạn mới có thể thực hành và ứng dụng làm bài tập một cách tốt nhất, đạt kết quả cao nhất. Mời các bạn cùng tham khảo và tải tài liệu tại đây.
Bảng hệ thống hóa các loại hợp chất vô cơ

Chọn file cần tải:
Có thể bạn quan tâm
-

Tổng hợp 300 câu trắc nghiệm Atlat địa lí Việt Nam trọng tâm nhất
-

Kể về một việc tốt em đã làm - 3 Dàn ý & 37 bài văn mẫu lớp 6 hay nhất
-

Đáp án tự luận Mô đun 9 môn Toán Tiểu học
-

Kể về ngày tết ở quê em (36 mẫu) - Tập làm văn lớp 3
-

Luyện từ và câu: Luyện tập về trạng ngữ - Tiếng Việt 4 Chân trời sáng tạo
-

Kể về một lần em mắc lỗi (bỏ học, nói dối, không làm bài...)
-
Chuyên đề phương trình bậc nhất một ẩn lớp 8
-

Viết đoạn văn kể về ước mơ của em (36 mẫu)
-

Tổng hợp đề thi vào lớp 10 các trường Chuyên trên cả nước (Có đáp án)
-

Suy nghĩ về câu nói của M. Go-rơ-ki "Hãy yêu sách, nó là nguồn kiến thức, chỉ có kiến thức mới là con đường sống"
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:











