Đề thi học sinh giỏi tỉnh Cà Mau lớp 12 năm 2011 môn Hóa học Sở GD&ĐT Cà Mau
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
ĐỀ THI HỌC SINH GIỎI VÒNG TỈNH LỚP 12 THPT
|
Câu I (4,0 điểm)
1. Một kim loại M có số khối bằng 54, tổng số hạt gồm (p+n+e) trong ion M2+ là 78
a) Xác định số thứ tự của M trong bảng hệ thống tuần hoàn.
b) Viết công thức cấu tạo của M2O3 , M3O4
c) Cân bằng phản ứng oxi hóa khử sau: ![]()
2. Trình bày quan hệ giữa số oxi hóa và hóa trị của nguyên tố. Cho thí dụ. Các chất và các ion dưới đây có thể đóng vai trò chất oxi hóa hay chất khử: Cl2, Fe2+, Cl-. Lấy các phản ứng để minh họa.
Câu II (3,0 điểm)
1. Đề nghị một phương pháp để tinh chế NaCl khan có lẫn các muối khan NaBr, NaI, Na2CO3.
2. Có 6 lọ chứa các dung dịch: CaCl2, NaOH, (NH4)2SO4, Ba(NO3)2, Pb(NO3)2, K2CO3 và được đánh số thứ tự. Hãy lập luận để xác định dung dịch nào chứa ở lọ số mấy khi
- Cho một giọt dung dịch 3 vào dung dịch 6 thấy xuất hiện kết tủa, nếu lắc thì kết tủa tan ngay.
- Dung dịch 6 không phản ứng với dung dịch 5 và cho khí mùi khai với dung dịch 2.
- Dung dịch 1 không tạo kết tủa với dung dịch 3, 4, 6.
- Dung dịch 2 và dung dịch 5 đều cho kết tủa trắng với 1, 3, 4. (không viết phương trình phản ứng)
Câu III (2,5 điểm)
1. Hoàn thành sơ đồ và viết phương trình phản ứng
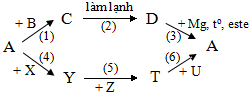
Biết A, B, C, D, X, Y, Z, T, U là các chất khí có thành phần nguyên tố thuộc: N, O, S, H.
2. Viết các phương trình phản ứng xảy ra khi:
a) Cho khí CO2 sục qua dung dịch nước Javen hoặc clorua vôi.
b) Nước clo tác dụng với dung dịch Natri thiosunfat.
c) Cho một ít axit Brom hydric vào nước Javen.
d) Để bạc ngoài không khí bị ô nhiễm H2S.
Câu IV (1,5 điểm)
1. Thêm từ từ 100 gam dung dịch H2SO4 98% vào nước và điều chỉnh để được 1 lít dung dịch A. Tính nồng độ mol của ion H+ trong dung dịch A.
2. Phải thêm vào 1 lít dung dịch A trên bao nhiêu lít dung dịch NaOH 1,8M để thu được:
a) Dung dịch có pH = 1.
b) Dung dịch có pH = 13.
Câu V (3,0 điểm)
Viết tất cả các đồng phân của C3H5Br3. Cho các đồng phân đó tác dụng với dung dịch NaOH thu được sản phẩm: Viết phương trình phản ứng và phân biệt các sản phẩm có nhóm chức khác nhau bằng phương pháp hóa học.
Câu VI (1,5 điểm)
Aspirin là loại thuốc được điều chế bằng cách este hóa axit salixylic (axit 2-hidroxi benzoic) bằng anhidrit axetic. Viết phương trình phản ứng dưới dạng công thức cấu tạo. Cho Aspirin tác dụng với NaHCO3 và với dung dịch NaOH. Viết các phương trình phản ứng dưới dạng ion.
Câu VII (2,0 điểm)
Hỗn hợp rắn A gồm kim loại M và một oxit của nó có khối lượng là 177,24 gam. Chia A thành 3 phần bằng nhau.
- Phần 1: Hòa tan trong dung dịch gồm HCl và H2SO4 dư được 4,48 lít khí Hidro.
- Phần 2: Hòa tan trong dung dịch HNO3 dư thu được 4,48 lít khí không màu hóa nâu trong không khí và dung dịch B.
- Phần 3: Đem đun nóng với chất khí CO dư đến khi phản ứng hoàn toàn thì cho toàn bộ chất rắn hòa tan hết trong nước cường toan dư thì chỉ có 17,92 lít khí NO thoát ra (các khí đều ở điều kiện tiêu chuẩn).
1. Xác định công thức của kim loại và oxit kim loại.
2. Nếu ở phần 2 cho thể tích dung dịch HNO3 là 1 lít và lượng HNO3 dư 10% so với lượng phản ứng vừa đủ với hỗn hợp kim loại và oxit.
a) Xác định nồng độ mol/lít của dung dịch HNO3.
b) Dung dịch B có khả năng hòa tan tối đa bao nhiêu gam M.
Câu VIII (2,5 điểm)
Một hợp chất A có M < 170. Đốt cháy hoàn toàn 0,486g A thu được 403,2ml CO2 (đktc) và 0,270g H2O
1. Tìm công thức phân tử A.
2. A tác dụng với dung dịch NaHCO3 và với Natri đều sinh ra chất khí với số mol bằng đúng số mol A đã dùng. Hỏi A có loại nhóm chức nào ? Xác định số lượng số nhóm chức đó có trong A. Viết phương trình phản ứng.
3. A và sản phẩm B tham gia phản ứng theo hệ số tỉ lượng như sau:
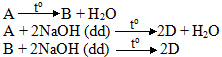
Những nhóm chức nào của A và B đã tham gia các phản ứng trên? Hãy dùng công thức đã tìm ra viết phương trình phản ứng đó và suy ra công thức cấu tạo của D, A, B. Biết rằng trong phân tử D có nhóm metyl.
Cho C = 12; H = 1; O = 16; Na = 23; Cl = 35,5; N = 14; Fe = 55,85; Al = 26,98; Ca = 40,08; Zn = 65,39.
Download tài liệu để xem thêm chi tiết
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:












 Đề thi học kì 1 Lớp 12
Đề thi học kì 1 Lớp 12
 Đề thi giữa học kì 1 Lớp 12
Đề thi giữa học kì 1 Lớp 12
 Đề thi giữa học kì 2 Lớp 12
Đề thi giữa học kì 2 Lớp 12
 Đề thi học kì 2 Lớp 12
Đề thi học kì 2 Lớp 12
 Soạn Văn 12 KNTT
Soạn Văn 12 KNTT
 Soạn Văn 12 CTST
Soạn Văn 12 CTST
 Soạn Văn 12 Cánh Diều
Soạn Văn 12 Cánh Diều
 Văn 12
Văn 12
 Toán 12 Chân trời sáng tạo
Toán 12 Chân trời sáng tạo