Đề thi học sinh giỏi lớp 12 THPT chuyên tỉnh Vĩnh Phúc năm 2013 môn Hóa học - Có đáp án Sở GD&ĐT Vĩnh Phúc
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
KỲTHI CHỌN HỌC SINH GIỎI CẤP TỈNH
|
Môn: HÓA HỌC – THPT CHUYÊN
Khóa ngày: 02/11/2012
--------------------------------
Câu 1: (1,0 điểm)
Hoà tan hoàn toàn 11,2 gam một kim loại R bằng dung dịch H2SO4 đặc nóng thu được SO2, cho toàn bộ lượng khí này hấp thụ hết vào 350 ml dung dịch NaOH 2M. Sau phản ứng, cô cạn dung dịch thì thu được 41,8 gam chất rắn khan.
1. Tìm kim loại R?
2. Hòa tan 8,4 gam kim loại R vào 200ml dung dịch HCl 2M thu được dung dịch A. Cho dung dịch A tác dụng với dung dịch AgNO3 dư, tính khối lượng kết tủa thu được?
Câu 2: (2,0 điểm)
1. Hãy cho biết dạng lai hóa của nguyên tốtrung tâm và dạng hình học theo mô hình VSEPR của các phân tử, ion sau: SF4; HClO2; HOCl; ICl4−; IF7; BrF5; HNO3; C2H6.
2. Khảo sát phản ứng phân hủy NO2 tạo thành NO và O2 ở100C dưới ảnh hưởng động học và nhiệt động học. Bảng sau cho biết tốc độ đầu của phản ứng phụ thuộc vào các nồng độ đầu khác nhau của NO2:

a) Xác định bậc của phản ứng và hằng số tốc độ phản ứng?
b) Một cách gần đúng, nếu xem như các đại lượng nhiệt động của phản ứng trên không phụ thuộc nhiệt độ. Hãy sử dụng các giá trị sau để trả lời các câu hỏi: nhiệt độ cần đạt đến để cân bằng dịch chuyển về phía phải là bao nhiêu?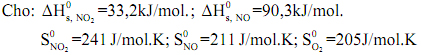
Câu 3: (2,0 điểm)
1. Khi axit hoá dung dịch hỗn hợp chứa [Ag(NH3)2]Cl 0,1M và NH3 1M đến khi dung dịch thu được có pH = 6 thì có xuất hiện kết tủa không? Tại sao?
Cho biết ![]()
2. Cho pin sau : H2(Pt),PH2 =1atm / H+: 1M // MnO4-: 1M, Mn2+: 1M, H+: 1M / Pt
Biết rằng sức điện động của pin ở 250C là 1,5V.
a) Hãy cho biết phản ứng thực tế xảy ra trong pin và tính EoMnO4-/Mn2+?
b) Sức điện động của pin thay đổi như thế nào khi thêm một ít NaHCO3 vào nửa trái của pin?
Câu 4: (1,0 điểm)
Đun nóng hỗn hợp gồm 1 mol HCOOH; 1 mol CH3COOH và 2 mol C2H5OH có H2SO4 đặc xúc tác ở toC (trong bình kín dung tích không đổi) đến trạng thái cân bằng thì thu được 0,6 mol HCOOC2H5 và 0,4 mol CH 3COOC2H5. Nếu đun nóng hỗn hợp gồm 1 mol HCOOH, 3 mol CH3COOH và a mol C2H5OH ở điều kiện như trên đến trạng thái cân bằng thì thu được 0,8 mol HCOOC2H5. Tính a?
Câu 5: (2,5 điểm)
1. Hãy gọi tên và giải thích sự khác nhau về nhiệt độ sôi các chất trong dãy sau:
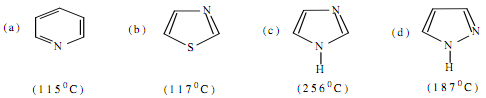
2. Vẽ công thức Fisơ của các hợp chất cacbohi đrat A, E1, E2, F1, F2 và G trong dãy chuy ển hóa sau:
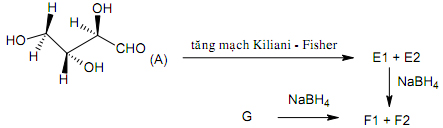
3. Cho sơ đồ chuyển hóa:
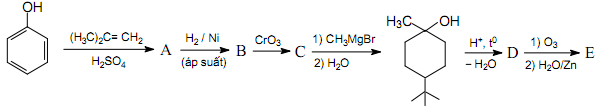
Hãy viết cấu tạo các chất từ A đến E?
Câu 6: (1,5 điểm)
1. Hợp chất (A) có công thức phân tử C10H10O không tạo màu với FeCl3, tạo sản phẩm cộng với NaHSO3. Cho (A) tác dụng với I2/NaOH không tạo kết tủa, axit hóa hỗn hợp sau phản ứng được (B) là C10H10O2, (B) làm mất màu dung dịch KMnO4. Cho (B) tác dụng với lượng dư brom khi có mặt Ag2O/CCl4 thu được (C) là 1,2,3-tribrom-1-phenylpropan.
Mặt khác, cho (A) tác dụng với NaBH4 thu được (D) là C10H12O. Hiđro hóa nhẹ D có xúc tác thu được (E) C10H14O. Đun nóng (E) với axit H2SO4 loãng thu được (F) là C10H12. Lập luận để xác định công thức cấu tạo của (A), (B), (D), (E). Viết phản ứng tạo thành (C) từ (B) và giải thích sự tạo thành (F) từ (E).
2. Viết cơ chế phản ứng sau:
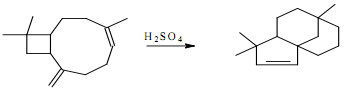
Download tài liệu để xem thêm chi tiết
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:












 Đề thi học kì 1 Lớp 12
Đề thi học kì 1 Lớp 12
 Đề thi giữa học kì 1 Lớp 12
Đề thi giữa học kì 1 Lớp 12
 Đề thi giữa học kì 2 Lớp 12
Đề thi giữa học kì 2 Lớp 12
 Đề thi học kì 2 Lớp 12
Đề thi học kì 2 Lớp 12
 Soạn Văn 12 KNTT
Soạn Văn 12 KNTT
 Soạn Văn 12 CTST
Soạn Văn 12 CTST
 Soạn Văn 12 Cánh Diều
Soạn Văn 12 Cánh Diều
 Văn 12
Văn 12
 Toán 12 Chân trời sáng tạo
Toán 12 Chân trời sáng tạo









